近日,我所蛋白质折叠与聚集研究组(212组)刘宇研究员团队与生物分子高效分离与表征研究组(1810组)张丽华研究员、赵群研究员团队,联合西湖大学张鑫教授团队,在脂滴(lipid droplets,LDs)聚集复合物组分解析和调控机制研究中取得新进展。合作团队建立了一种基于小分子光催化剂的蛋白质邻近标记技术(LipoID),在活细胞中快速标记捕获脂滴周边的相互作用蛋白;通过LC-MS/MS质谱鉴定与互作网络解析,发现线粒体-脂滴通过VDAC3-PLIN3分子触点调控空间互作距离,并重塑相关脂代谢通路。
生物体中的蛋白质、核酸和脂质等生物分子在应激和疾病条件下易发生聚集,形成生物聚集体。其中,脂滴作为细胞内一种高度动态的生物聚集体,是脂质储存与代谢调控的核心亚细胞器,并与线粒体和内质网等细胞器频繁互动,兼具能量供应、膜脂合成前体储备及细胞应激保护等关键功能,对细胞代谢重编程与多种疾病发生发展具有重要意义。然而,调控脂滴与亚细胞器互作聚集的分子机制是有待阐明的科学问题。
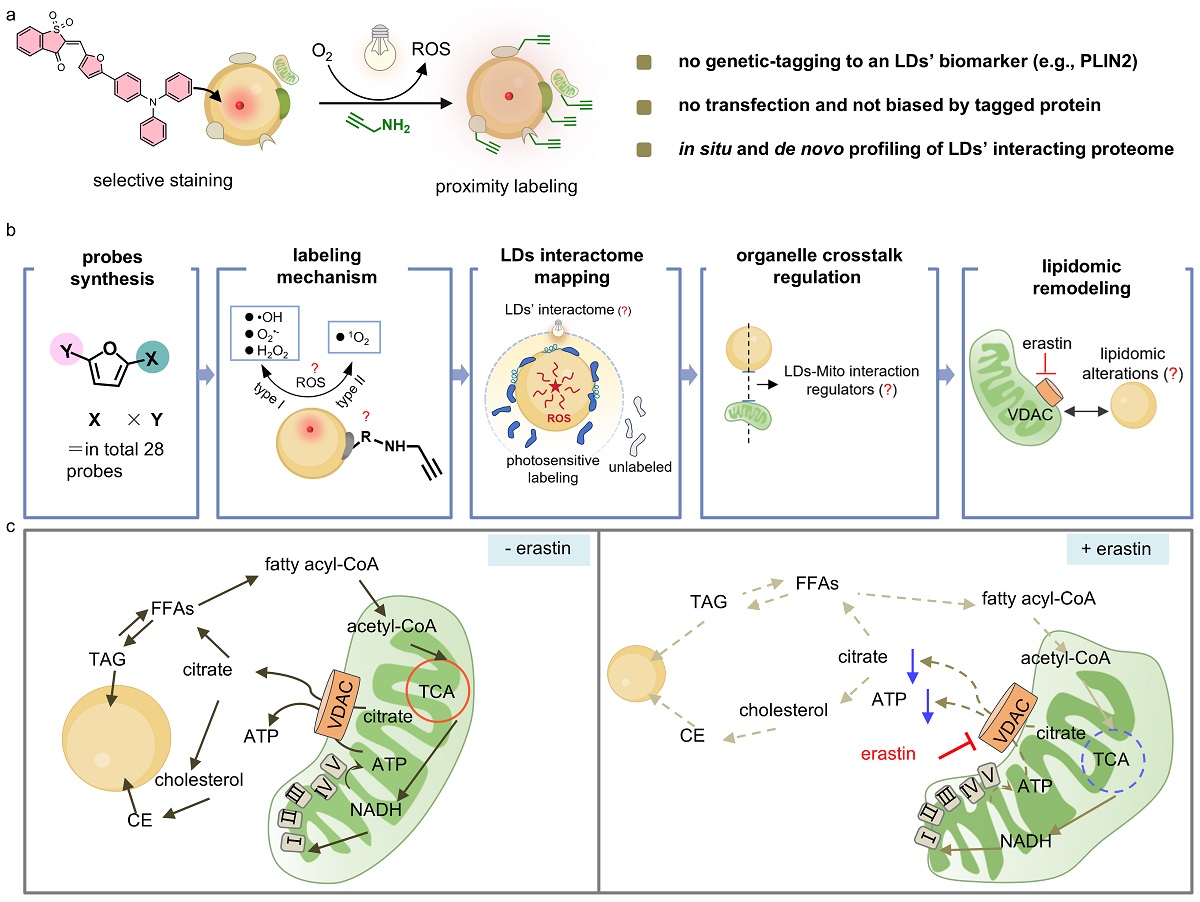
传统脂滴离体分离分析技术面临脂滴易破碎、弱/瞬时互作丢失、非特异吸附等技术挑战,难以在活细胞原位、工况条件下精准还原真实的互作网络信息。 针对上述技术瓶颈,合作团队提出并建立了LipoID光催化邻近标记策略:通过设计具有脂滴靶向能力与光催化活性的小分子探针,可富集于活细胞脂滴微环境;温和短时光照触发探针产生活性中间体,介导脂滴邻近区域蛋白质的快速标记。随后,合作团队建立了富集纯化与高分辨质谱鉴定方法,实现了脂滴互作蛋白组的高覆盖精准解析,覆盖多类脂代谢相关酶与调控因子,验证了其用于脂滴互作网络解析的可靠性。
进一步,合作团队聚焦“调控脂滴与亚细胞器互作聚集的分子机制是什么?”这一核心科学问题,利用LipoID比较蛋白组学技术研究发现“PLIN3-VDAC3-ATP-线粒体互作”的调控轴,即抑制VDAC3会降低细胞ATP水平,并增大脂滴-线粒体空间距离,同时伴随脂滴-线粒体-微管空间耦联的重构与脂质代谢通路(TAG/CE/FFA等)的系统性改变。该研究为理解脂滴-亚细胞器聚集互作提供了组学分析工具,为深入探索代谢与神经退行性疾病中脂滴聚集体的生理病理角色奠定基础。
相关成果以“LipoID Profiles Lipid Droplets Interactions and Identifies Inter-Organelle Regulators”为题,于近日发表在《自然-化学生物学》(Nature Chemical Biology)上。该工作共同第一作者是212组助理研究员郭恒科、副研究员万旺,西湖大学博士研究生黄亚男,1810组工程师赵楠。本研究得到国家自然科学基金、我所创新基金等项目的支持。(文/图 郭恒科)






