近日,我所蛋白质折叠与聚集研究组(212组)刘宇研究员团队和生物分子高效分离与表征研究组(1810组)张丽华研究员、赵群研究员团队合作,通过对淀粉样变蛋白病理检测工具分子——硫黄素T进行系统性结构改造,实现了阿尔茨海默病小鼠脑组织中淀粉样沉积物的光催化邻近标记,并原位解析了其组成成分和相互作用信息。
阿尔茨海默病(AD)是最常见的神经退行性疾病之一,其核心病理特征为脑内淀粉样变β蛋白斑块和异常磷酸化Tau缠结的持续累积。大量临床与病理学证据表明,淀粉样沉积在疾病起始与进展中具有关键驱动作用。目前,已有多种成像探针可用于淀粉样沉积的可视化检测,但在淀粉样变蛋白沉积物的组分分析方面,仍主要依赖于传统的差速离心与激光显微切割等复杂分析技术。这些方法存在空间分辨率低、通量有限、设备成本高等技术局限,难以对复杂脑组织中的淀粉样沉积进行系统性组分解析。因此,亟需开发新型、精准且高效的组织原位解析技术。
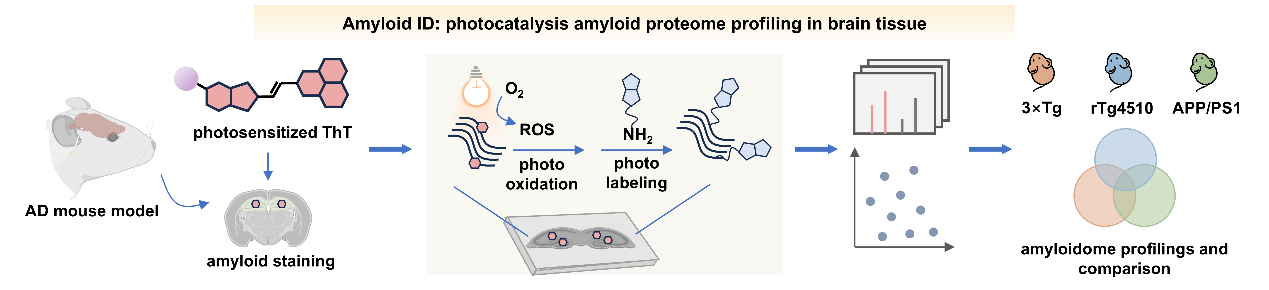
针对上述技术难点,合作团队发展了一种基于有机小分子的光催化邻近标记策略(Amyloid-ID)。该策略利用光敏分子产生的活性氧中间体与标记底物炔丙胺,实现了AD小鼠脑切片中淀粉样沉积物的原位标记与富集,以及其组分与蛋白互作网络的系统性解析。合作团队从经典淀粉样变蛋白染料硫黄素T(Thioflavin T,ThT)的结构出发,通过在分子中延长共轭体系并引入重原子,将ThT的荧光性质高效转化为光敏性质(P9)。随后,合作团队在AD小鼠脑组织切片中,进一步建立了淀粉样变蛋白的分离富集与蛋白质组学分析方法,鉴定出AD的核心致病蛋白tau蛋白。研究发现,不同表型AD小鼠模型(APP/PS1、rTg4510、3×Tg)中,淀粉样沉积的蛋白质组分有超过60%的重叠,并共同富集到线粒体相关通路。该结果支持了“线粒体功能障碍是阿尔茨海默病核心机制之一”的观点。Amyloid-ID技术的发展为神经退行性疾病中致病蛋白的组分与互作研究提供了新的分析工具与方法支撑。
上述研究以“Amyloid-ID: photocatalytic profiling of amyloid deposits in Alzheimer’s disease tissue”为题,于近日发表在《自然-通讯》(Nature Communications)上。该工作的第一作者是我所212组博士毕业生冯焕与1810组赵群研究员。上述工作得到了国家自然科学基金、中国科学院青促会、辽宁省杰出青年科学基金、大连市杰出青年科学基金、我所创新基金等项目的资助。(文/图 冯焕、赵群)