近日,我所生物技术研究部分子探针与荧光成像研究组(1818组)徐兆超研究员、苗露副研究员团队通过调控荧光蛋白与荧光染料之间的荧光共振能量转移(Fluorescence resonance energy transfer,FRET),提高了荧光蛋白的光稳定性,并基于化学遗传学策略赋予外源荧光染料遗传编码荧光,解决了荧光染料因非特异性标记而产生背景荧光信号的问题,协同提高了荧光蛋白和染料在活细胞成像中对靶蛋白标记和成像的性能。
荧光蛋白和荧光染料是分子探针和生物成像中的两种主要荧光团,但各自存在发光和应用上的局限。荧光蛋白因遗传编码的属性具有专一靶向性和优良生物相容性,但其光稳定性较差,且结构改造困难;而荧光染料则在光稳定性和光谱多样性上具有优势,但作为外源物质在细胞内的靶向性较差,且难以精确控制染料分子在细胞内的定位和数量,存在背景荧光干扰的问题。研究团队提出了一种化学遗传策略,将合成染料与遗传编码荧光蛋白通过FRET机制相结合,使两者在化学性能和发光性能上优势互补和取长补短,实现了目标蛋白的高保真和免洗成像。
团队构建了荧光蛋白(FPs)和HaloTag标签蛋白染料之间的荧光共振能量转移(FRET)系统,这种杂化FRET体系依赖于荧光染料的光稳定性,通过分子内FRET与给体FPs的单线态到三线态跃迁过程(ISC)相竞争,有效抑制系统中FPs的光漂白效应,提高了荧光蛋白的光稳定性,实现了对靶标蛋白的长时程追踪。团队以红色荧光蛋白(mApple/mCherry)为供体,光稳定的小分子染料四甲基硅罗丹明为受体,构建了一系列具有不同FRET效率的遗传编码体系。研究结果显示,FRET效率越高的体系中供体RFP光稳定性越强,其中CH-1体系中mCherry的光稳定性提高了近6倍。此外,该体系中RFP的ROS生成显著减少,表明RFP的三重态转变受到FRET和ISC竞争的影响。这一体系在长时间动态SIM成像中能够捕捉更多的线粒体分裂事件。进一步,团队追踪到线粒体裂变过程中与溶酶体和内质网的相互作用,发现内质网参与了所有的线粒体裂变事件,而溶酶体只参与了其中的66%。
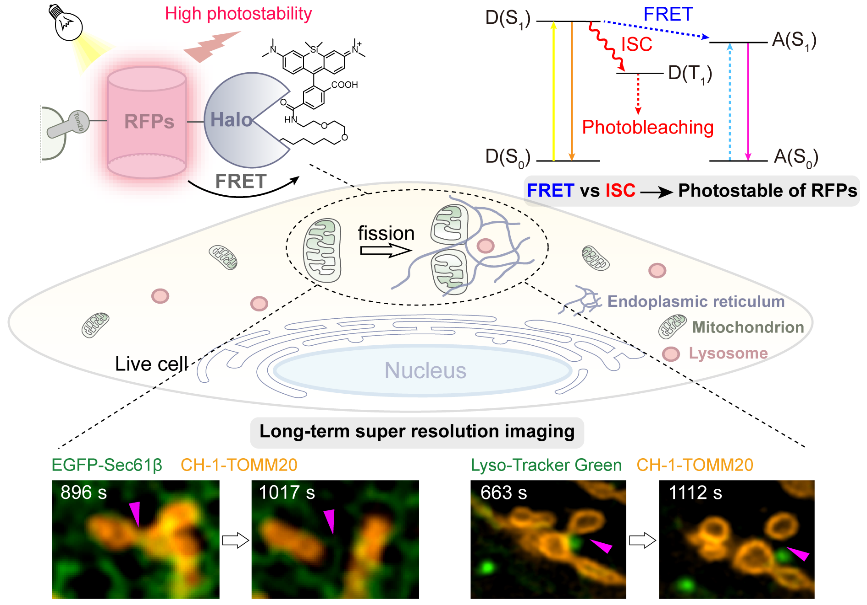
在这种杂化FRET系统中,染料荧光发射依赖于FPs供体激发的系统,仅与靶蛋白结合的染料发荧光,非特异性结合的染料保持暗态,这样就赋予了外源荧光染料遗传编码荧光,从而显著提升染料标记靶蛋白的信噪比(SNR)。团队以HaloTag染料氧罗丹明和硅罗丹明(Halo-O-Rho,Halo-Si-Rho)为例,通过将HaloTag分别与sfGFP/mCherry融合,构建出sfGFP&O-Rho,mCherry& Si-Rho 两对基因编码FRET对。结果表明,在低靶蛋白表达水平下能产生具有高信噪比的遗传编码荧光。此外,通过对FRET效率的系统优化,该团队构建的CH-Si实现了对靶蛋白的多色结构光照明显微镜(SIM)成像,并且动态追踪了线粒体与内质网和溶酶体相互作用。

以上研究成果分别以“Enhancing Photostability of Red Fluorescent Proteins through FRET with Si-Rhodamine for Dynamic Super-Resolution Fluorescence Imaging”和“Chemogenetic Encoding of Fluorescent Dyes Enables High-Fidelity and Wash-Free Imaging of Proteins in Live Cells”为题,发表在《化学科学》(Chemical Science)和《先进科学》(Advanced Science)上。上述两项工作的第一作者为1818组已毕业博士周雪莲,以上研究工作得到国家自然科学基金、我所创新基金等项目的资助。(文/图 周雪莲、苗露)
文章链接:https://pubs.rsc.org/en/content/articlelanding/2025/sc/d5sc02442k;https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202505967






