近日,我所分子反应动力学国家重点实验室分子模拟与设计研究组(1106组)李国辉研究员团队与中国科学院生物物理研究所孙飞研究员团队、北京大学医学部尹长城教授合作,利用冷冻电子显微术解析了小鼠骨骼肌三联体的天然结构,同时利用分子动力学模拟揭示了三联体超复合结构结合界面和协同耦合机制关联的结构动力学机制。
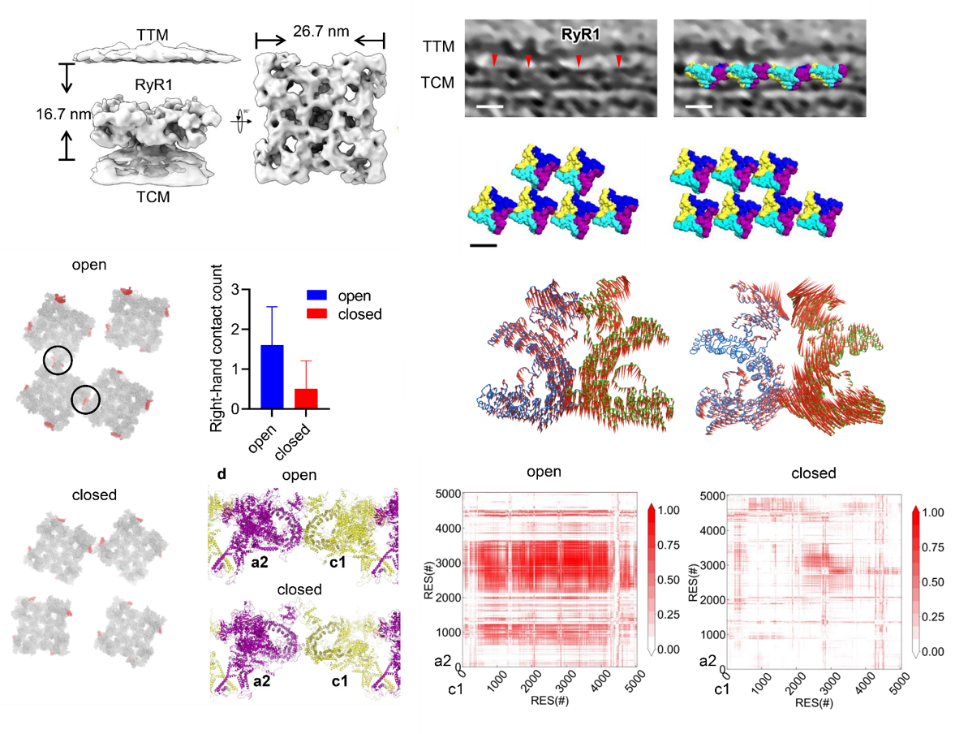
在骨骼肌收缩的“兴奋-收缩”耦合(ECC)生物过程中,骨骼肌三联体扮演重要的角色。在骨骼肌横小管膜上的一种钙离子通道二氢吡啶受体(DHPR)感知兴奋信号后,通过与下方肌浆网膜上的高通量钙通道蛋白RyR1的结合偶联引起肌浆网释放钙,诱导随后的肌丝收缩。这个复杂的生物信号转导涉及肌浆网膜上RyR1聚集的特定排列,以及RyR1与横小管膜上四个DHPR的相互作用模式。然而,由于缺乏结构细节,其分子机制尚不清楚。
本工作中,原位结构解析实验团队与李国辉团队合作,共同揭示形成特定排序阵列下的RyR1超复合物,以及RyR1-DHPR超复合物在“兴奋-收缩”耦合过程中的动态分子偶联运动机制。原位结构解析实验团队利用原位冷冻电子显微术在分子分辨率上解析了16.7 Å分辨率的小鼠骨骼肌三联体的天然结构。其中,RyR1复合物(包含RyR1、FKBP12和钙调蛋白)形成“右角-右角” 结构域排列方式,同时发现RyR1能够与横小管膜上四个DHPR结合。为了了解RyR1s右角对角排列的生物学重要性,李国辉团队通过多尺度分子动力学模拟进一步揭示了不同状态下RyR1复合物二聚之间,以及RyR1复合物与上层膜的四个DHPR蛋白之间的结合界面和协同耦合机制关联的结构动力学。三联体超复合物的原位结构为它们在骨骼肌中的机械偶联提供了直接证据,结构解析与分子动力学模拟共同揭示控制骨骼肌“兴奋-收缩”耦合中超复合物结合界面和协同耦合机制关联的分子机制。
相关研究成果以“In situ structural insights into the excitation-contraction coupling mechanism of skeletal muscle”为题,于近日发表在《科学前沿》(Science Advances)上。该工作的共同第一作者是中国科学院生物物理研究所徐嘉树博士和我所副研究员廖晨伊。以上工作得到了国家自然科学基金、中国科学院B类先导专项“生物大分子复合体结构与功能的跨尺度研究”等项目的支持。(文/图 廖晨伊)