近日,我所生物技术研究部分子探针与荧光成像研究组(1818组)徐兆超研究员团队采用活细胞蛋白定点荧光标记和多色动态超分辨荧光成像的方法,追踪并分辨出新冠病毒刺突蛋白受体结构域(RBD)进入细胞和胞内降解全过程的多个重要步骤,为新冠病毒致病机理的理解和药物筛选提供参考和工具。
新冠病毒感染始于病毒的RBD与宿主细胞血管紧张素转换酶2(ACE2)的结合,之后经历多阶段、多分子的协同作用内吞感染细胞。但这一过程极易受环境干扰,病毒内吞的许多关键调控分子和感染细节目前仍然未知。而在活细胞水平上对病毒感染细胞过程的高时空分辨追踪,能够全面、真实地揭示病毒的感染机制。
团队前期发展了活细胞中实时、快速筛选新冠病毒抑制剂的新方法,能够在1小时内定量检测被分析物的抑制作用,并最终从2056个化合物中成功筛选出抑制新冠病毒的小分子抑制剂(Acta Pharmaceutica Sinica B,2022)。本工作将Halo和SNAP蛋白标签分别对RBD和ACE2进行基因编码,通过标记位点的优化选择保证了靶蛋白的活性(EC50=25nM)。团队选择不同颜色的荧光染料活细胞原位共价连接在蛋白标签上,从而实现对RBD和ACE2的活细胞标记。借助SIM超分辨成像,团队追踪了新冠病毒RBD内吞和细胞内降解的全过程,并发现了多个重要步骤及其细节:RBD与ACE2的结合启动了内化过程,并形成富含ACE2的囊泡来运输RBD;随后,RBD/ACE2囊泡沿微管快速移动,囊泡之间接触、融合和物质交换,并且在不同微管之间转移;最后,RBD和ACE2被溶酶体吸收和降解,囊泡中游离ACE2释放到细胞质中被重新利用。
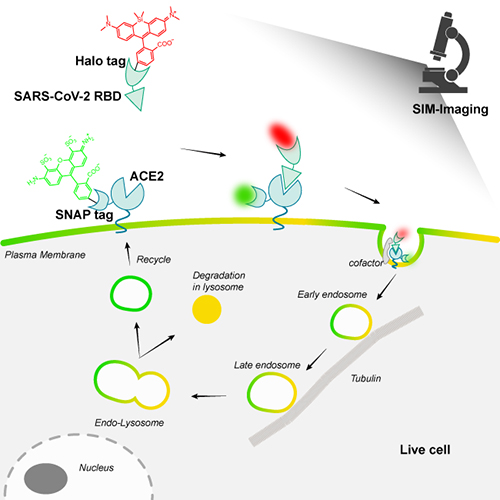
近几年新冠、甲流和诺如病毒频发,严重影响了人们的生命健康,病毒持续的变异敦促着科研人员对其感染机制开展广泛而持久的研究。新冠病毒致病机理的超分辨成像研究策略为更多流行病毒的研究打开了新的思路,有助于我们寻求更有效的预防、诊断和治疗策略。
相关研究成果以“SIM Imaging Resolves Endocytosis of SARS-CoV-2 Spike RBD in Living Cells”为题,于近日发表在Cell. Chem. Biol.上。该工作的共同第一作者是我所1818组苗露副研究员和博士研究生焉春雨。上述工作得到国家自然科学基金、辽宁省应急攻关项目、我所创新基金等项目的资助。(文/图 苗露)






