近日,我所蛋白质折叠化学生物学创新特区研究组(02T5组)刘宇研究员团队,与山东大学刘晓静教授、中科院生物物理所王磊研究员、大连医科大学第二附属医院高振明教授合作,通过发展对蛋白质错误折叠与聚集敏感的溶剂致变色荧光探针,定量测量了胞内多种致病蛋白质的内部极性微环境。该工作揭示了聚集态蛋白质在微结构与种类上的极性差异性,并建立了蛋白质聚集态极性与其致病能力的相关性。
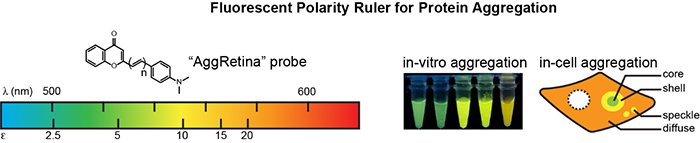
细胞内蛋白质的错误折叠与聚集会引发多种蛋白质构型疾病,如阿尔兹海默症、帕金森症、渐冻人症和心肌淀粉样变等。早期针对聚集态蛋白质的研究通常聚焦于其聚集态形貌与聚集过程的生化机理。然而,针对其本身物理和化学性质(如极性、粘稠度、氧化还原性质、酸碱度、化学反应性等)的定量信息相对匮乏。此外,近期多项研究显示,聚集态蛋白质的这些理化性质与其致病机制有着密切关系。
课题组在前期多种聚集态蛋白质探针(Anal. Chem.,2021;Angew. Chem. Int. Ed.,2021;Angew. Chem. Int. Ed.,2021;Chem. Sci.,2021)的研究基础上,进一步发展了一类同时具有对极性微环境和聚集态蛋白质敏感度的荧光探针(AggRetina)。该类探针可选择性结合聚集态蛋白质,并根据其内部极性微环境的不同发出不同波长的荧光。利用所构建的波长与极性的线性关系,可定量测量不同蛋白质聚集态的极性差异性。更重要的是,这种极性差异性与其蛋白酶解速率密切相关,从分析化学的角度侧面阐释了其致病性。通过活细胞荧光成像,该探针在胞内观察到致病蛋白质所形成的聚集体具有结构上的异质性。该工作为后期进一步通过蛋白质组学分析聚集态蛋白质组提供了新的研究方向。
上述成果以“A Solvatochromic Fluorescent Probe Reveals Polarity Heterogeneity upon Protein Aggregation in Cells”为题,于近日发表在《德国应用化学》(Angew. Chem. Int. Ed.)上。该工作的共同第一作者是我所02T5组博士后万旺和职工曾亮钢。该工作得到了国家自然科学基金、辽宁省兴辽人才计划、大连市科创基金、博士后面上基金等项目的支持。(文/图 万旺)






